蛋白质是生命活动的执行者。蛋白质同其它生物分子(包括蛋白质、核酸、代谢分子及其它分子)的相互作用是执行各类生物功能的关键要素。研究生物分子-蛋白质的相互作用是生物学研究中的基本问题。
源自上海交通大学科研团队开发的⼀项新型邻近标记技术(专利号ZL202110069353.7)[1],命名为Specific Pupylation as IDEntity Reporter (SPIDER),其原理来自结核分枝杆菌类泛素蛋白酶体系统中底物Pup分子在体外能够招募PafA连接酶发挥邻近标记作用[2]。该技术可应⽤于蛋白-蛋白、蛋白-核酸、蛋白-小分子的相互作用的验证和发现。相比其他生物分子-蛋白互作检测技术,该方法无需提前将标签和诱饵分子进行融合,摆脱对融合蛋白表达准确性的依赖,应用范围更广;此外,该技术可以用严苛的条件进行洗脱,降低非特异蛋白的干扰,富集能力强,结果准确性更高,同时兼具操作简单快捷的优点。
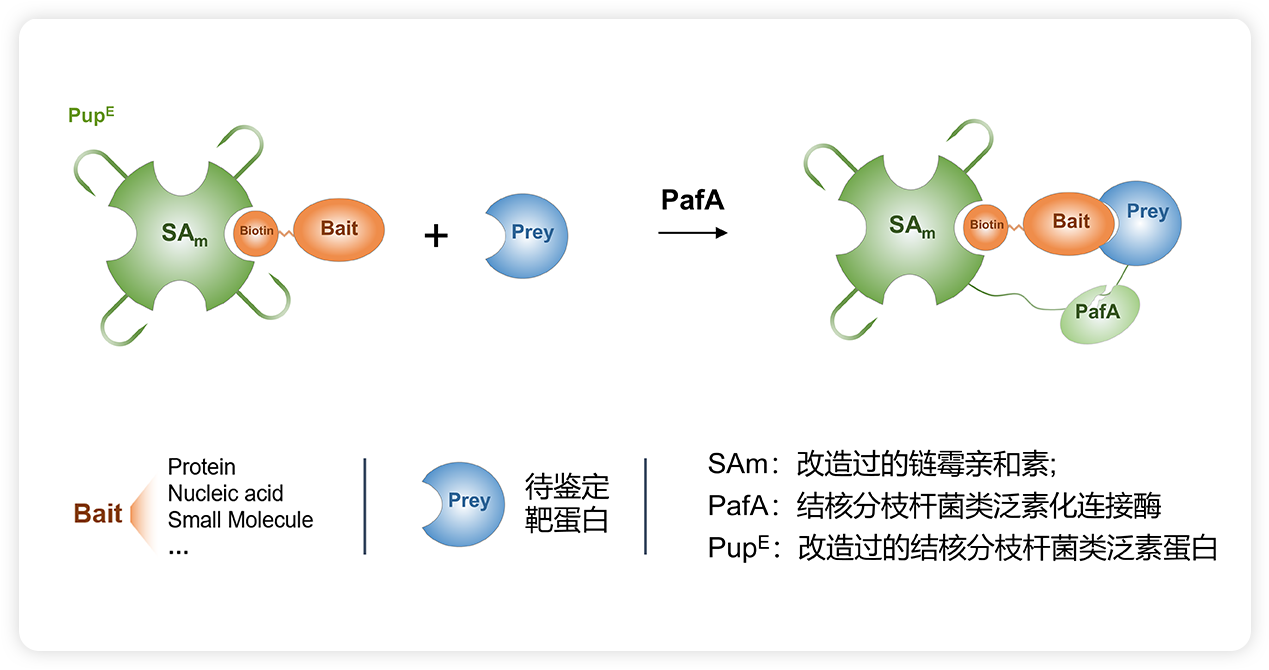
当靶蛋白(Prey)与带有生物素标记的生物分子(Bait)发生相互作用时,会同时与偶联了生物素的 SAm-PupE 靠近,在 PafA 酶的催化作用下,PupE 的C末端会与Prey蛋白表面的赖氨酸残基共价相连,从而实现对靶蛋白的捕获。该过程将生物分子与蛋白质之间的非共价结合相互作用转换为SAm-PupE与靶蛋白的共价连接,从而能够稳定地用于后续靶蛋白的富集、鉴定和分析。
该技术可以用于体外筛选及验证与各种生物分子相互作用的蛋白质:诱饵分子的类型包括小分子药物、代谢小分子、蛋白质、DNA/RNA等;待鉴定靶蛋白的形式除了常规的细胞裂解液,还可以是完整的活细胞。

