蛋白-蛋白相互作用是生命活动的基本要素。鉴定关键蛋白的相互作用蛋白(靶蛋白)是解析关键蛋白的功能和调节的重要手段,是生命科学研究中常见的需求。
抗码生物在蛋白-蛋白相互作用检测上,可提供两套方案供选择:
在传统Pulldown+质谱技术的基础上,通过结合结核分枝杆菌糖基化途径的基于底物的亲近性标记活性和链霉亲和素(SA)-生物素系统,上海交通大学团队开发了特异性糖基化作为标识报告物(SPIDER,Specific Pupylation as IDEntity Reporter)方法来识别蛋白-生物分子的相互作用,该技术可用于小分子药靶鉴定、结合蛋白筛选等应用中。
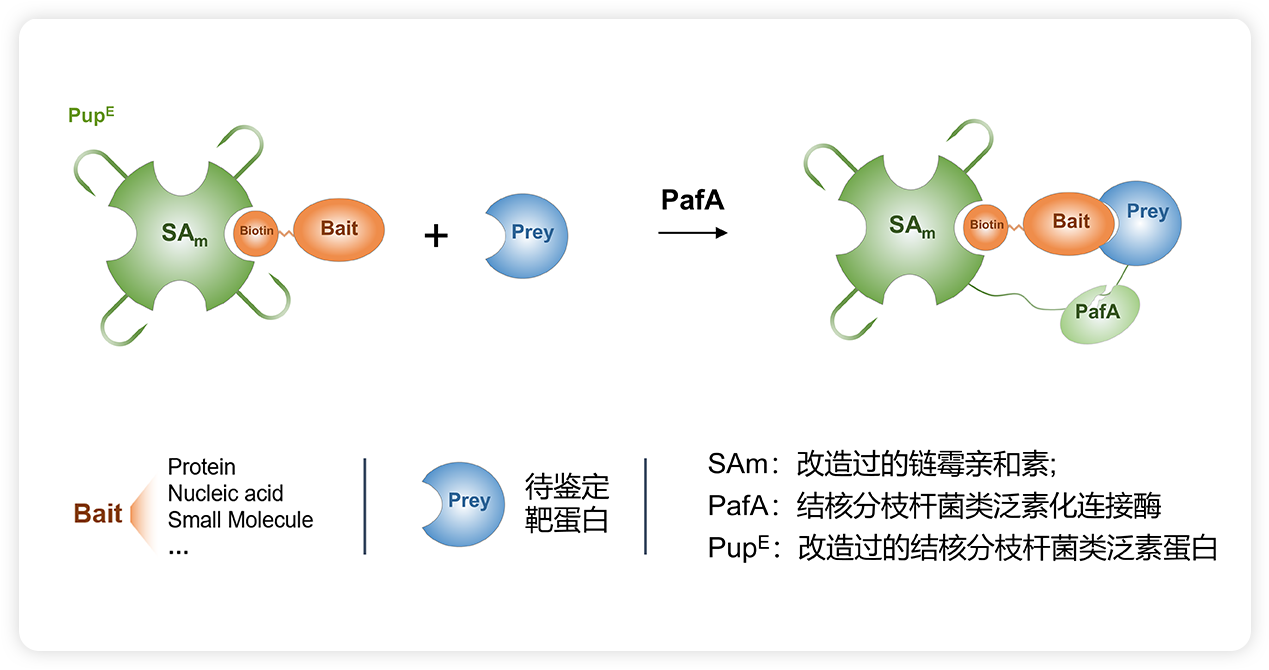
SPIER技术原理
应用案例:酶底物蛋白的鉴定
为了扩展SPIDER在细胞环境中检测瞬时相互作用如蛋白质-蛋白质相互作用的应用,我们鉴定了大肠杆菌蛋白去乙酰化酶CobB的相互作用。我们通过将生物素化CobB与在温和裂解条件下制备的稳定同位素标记的大肠杆菌裂解液共孵育来进行SPIDER实验,共鉴定出84个相互作用蛋白(如下图),其中一半相互作用蛋白已被报道验证。
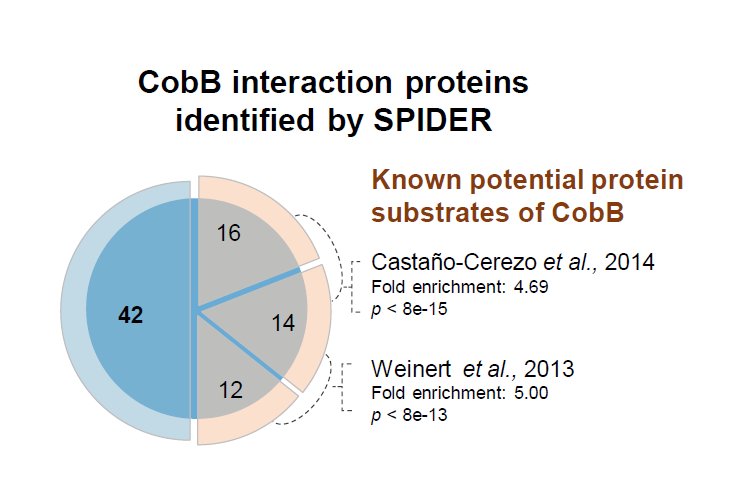
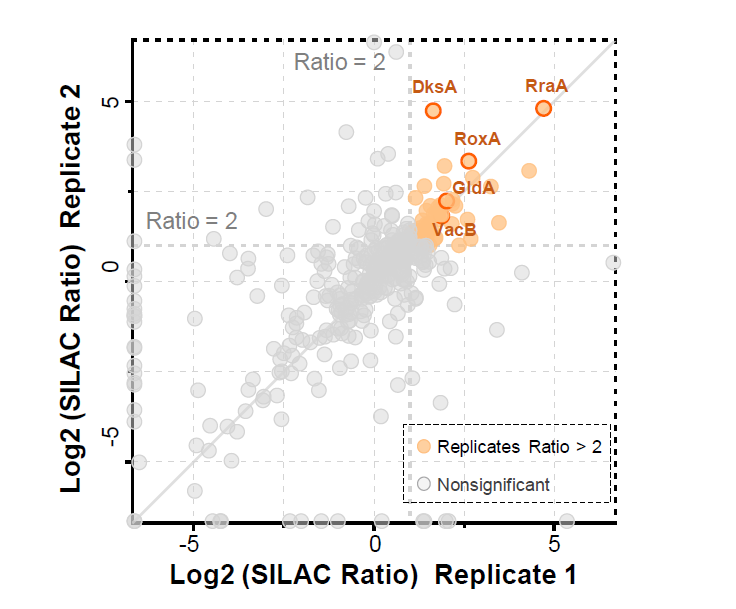
SPIDER用于酶-底物相互作用实验结果图
与传统Pulldown+MS相比,SPIDER+MS具有显著的优势:1) 适用于膜蛋白鉴定,可支持活细胞-诱饵分子结合和检测;2)通用性强,诱饵分子可为蛋白质、抗体、DNA/RNA、小分子等多种类型;3)可检测弱相互作用。此外,SPIDER+MS比其它邻近标记技术亦有诸多优势,详见下表:
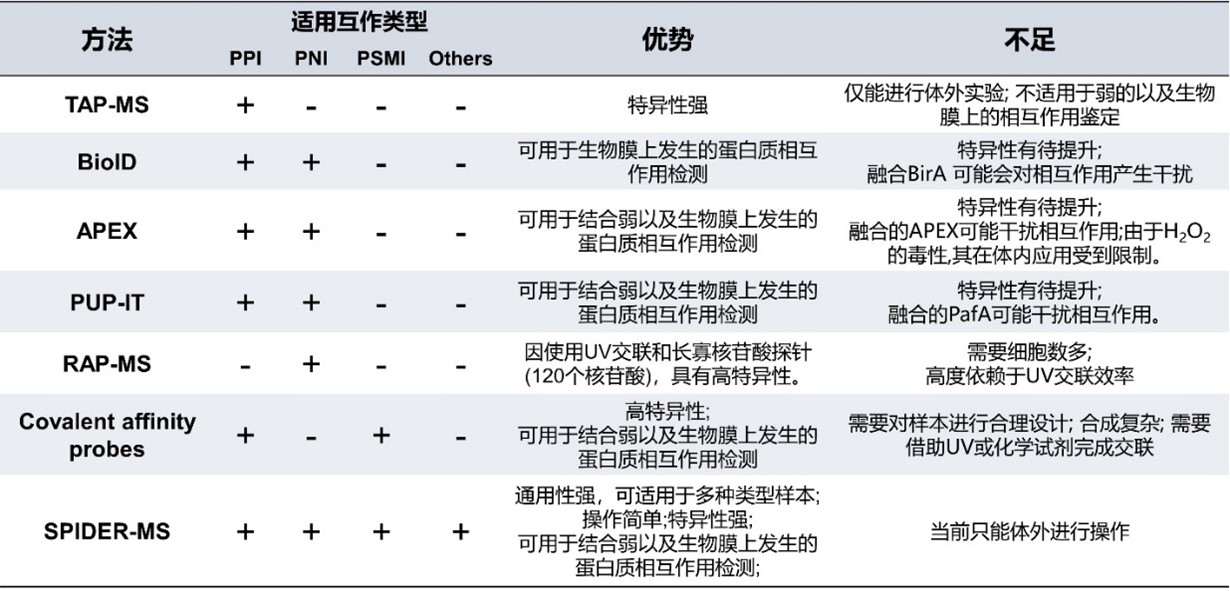
SPIDER与其它邻近标记技术的比较
HuProtTM人类全蛋白质芯片是蛋白质—生物分子互作检测的有力工具,通过芯片,能够大大提高筛选范围和检测效率。
应用案例:芯片在扩张型心肌病研究上的应用
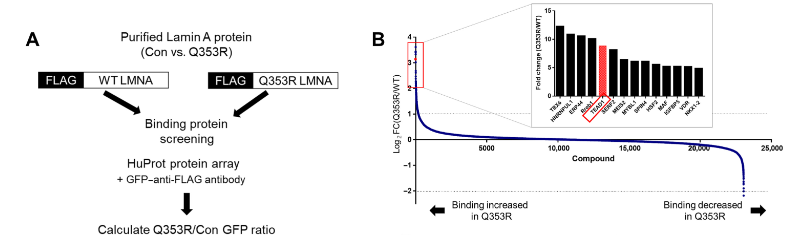
Science Advances-结合蛋白筛选流程及结果
HuProtTM人类全蛋白质芯片固定了>21,000种人重组蛋白,其中~90%为全长蛋白。该芯片天然是一种高质量的蛋白质自身抗原库,能够精确定位于靶点蛋白结合的小分子,并且可以实现特定环境下难以捕捉的靶标鉴定。
原文链接:TEAD1 trapping by the Q353R–Lamin A/C causes dilated cardiomyopathy